風邪のウイルスががん細胞を破壊する
概要
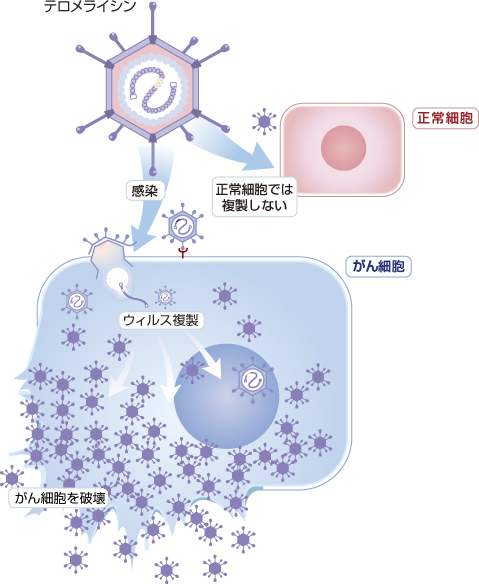
がんのウイルス療法テロメライシン®(OBP-301)は、がん細胞で特異的に増殖し、がん細胞を破壊することができるように遺伝子改変された5型のアデノウイルスです。5型のアデノウイルス自体は風邪の症状を引き起こすもので、自然界の空気中にも存在します。
がんのウイルス療法であるテロメライシン®は、テロメラーゼ活性の高いがん細胞で特異的に増殖することでがん細胞を溶解させる強い抗腫瘍活性を示します。また、正常な細胞の中ではテロメラーゼ活性が低くテロメライシン®の増殖能力が極めて低いため、臨床的な安全性を保つことが期待されています。体の負担も少なく、これまで嘔吐・脱毛・造血器障害などの重篤な副作用は報告されていないことから、患者様のQOL(Quality of Life)の向上が期待されます。テロメライシン®は、放射線治療や化学療法剤との併用により、更に強力な抗腫瘍活性が導き出せることも明らかになっています。
当社は、「がんを切らずに治す」というコンセプトに基づき開発を進めているテロメライシン®に関して、放射線治療や免疫チェックポイント阻害剤等の併用に関する更なる検討を進め、医療現場の一助となるがんの治療法の発展へ貢献してゆきたいと考えています。
なお、食道がんへの開発に関して、日本国内においては2019年4月に厚生労働省より先駆け審査指定制度の対象品目に指定され、さらに米国においては、2020年6月にオーファンドラッグ(希少疾患治療薬)の指定を米国食品医薬品局(FDA:Food and Drug Administration)から受けております。
対象疾患
食道がん、胃・胃食道接合部がん、肝臓がんなどの固形がん
開発の状況
進捗に関しては、「パイプラインの概要:パイプラインの進捗一覧 」をご参照ください。
開発進捗に関する詳細は、決算短信末尾にあります「研究開発状況」をご参照ください。
特許の概況
テロメライシン®は、平成18年10月に日本国内の特許(特許第3867968号)を取得しました。更に平成24年4月に米国での特許(米国特許第8,163,892号)が成立した後、平成26年3月に欧州でも特許(欧州特許第1553178号)を取得し欧州内の14か国への登録を完了しています。平成29年1月末時点で世界24ヶ国での特許取得が完了しています。
- (特許取得済みの国)
- 日本・米国・欧州(14か国)・南アフリカ・シンガポール・ニュージーランド・オーストラリア・中国・香港・韓国・カナダ
詳しくはこちらもご参照ください。















